Specialist Peter Christian Strøm giver en grundlæggende gennemgang af stamceller og deres kliniske anvendelse til kæledyr.
Stamcelleterapi er et innovativt og relativt nyt felt inden for lægevidenskaben. Dets eksperimentelle og kliniske anvendelse ser også lovende ud for en lang række sygdomme indenfor veterinærbranchen. Anvendelse af stamceller inden for veterinærmedicin er stadigvæk i det spæde stadie, men har udviklet sig markant og hurtigt over det sidste årti. I de sene 90’ere og 00’ere fik denne form for behandling for alvor fat. Stamceller var dengang mest almindeligt anvendt i kliniske veterinærmedicinske lægemidler i terapeutiske applikationer til behandling af muskuloskeletale skader hos heste og hunde (1). I takt med den øgede interesse i den veterinærmedicinske forskning og dyrejeres søgen efter alternative behandlingsmodaliteter, er de unikke modulerende virkninger af stamceller også i videre udstrækning blevet udforsket og benyttet til andre sygdomstilstande end muskuloskeletale lidelser hos dyr.
Det er velkendt, at stamceller kan differentiere sig til specifikke celletyper og regenerere. ”Stamcelle” er et generisk udtryk, der refererer til enhver uspecialiseret celle, der er i stand til langsigtet selvfornyelse gennem celledeling, men som kan induceres til at differentiere til en specialiseret og funktionel celle (2). Disse udifferentierede eller uspecialiserede celler med evnen til selv at forny og differentiere til vævsceller med specialiserede funktioner gør dem unikke. Stamcelleterapier bruges derfor til at overvinde kroppens manglende evne til at regenerere beskadiget væv og metaboliske processer efter for eksempel akut eller kronisk inflammation (3).
Konceptet stamcelleterapi blev først introduceret i 1991 af Caplan, som foreslog, at massiv differentiering af celler til det ønskede væv kunne opnås ved isolering, dyrkning og udvidelse af stamceller under *in vitro* betingelser (4).
Stamcelleterapi bliver ofte anskuet som synonym for regenerativ medicin. Regenerativ medicin er en gren af den medicin, der beskæftiger sig med metoder til at dyrke, reparere eller erstatte
beskadigede eller syge celler, organer eller væv. Stamcellebehandling kan betragtes som et af de tilgængelige værktøjer i det udviklende område af regenerativ medicin.
Selvom stamceller oprindeligt blev anset for at være kilden til en supercelle, der ville differentiere og erstatte beskadiget eller sygt væv, er det blevet tydeligt, at de terapeutiske egenskaber af mesenkymale stamceller opnås hovedsageligt gennem deres immunmodulerende funktioner, som virker i interaktion med immunsystemets celler. Komplekse immunmodulerende aktivitet af stamceller inkluderer deres sekretion af ekstracellulære vesikler (ECV), parakrine virkning, apoptose-medieret immunmodulering og mitokondriel overførsel af membranvesikler og organeller. Den parakrine funktion finder sted gennem signaler til kroppens immunforsvarsceller. De parakrine stoffer er involveret i flere biologiske processer, såsom differentiering af celler, sårheling og angiogenese (5, 6, 7). Stromale stamceller har evnen til at overføre forskellige molekyler gennem de ekstracellulære vesikler (ECV). ECV’er er vesikler, der opstår fra plasmamembranen ved udadgående eller indadgående knopper. De er bland andet bærere af miRNA, mRNA, proteiner og mitokondrier, der er beskyttet af vesikelmembranen. ECV’er funktion er at forbedre makrofagers funktion via prostaglandin (PGE2) aktivering (8). Derudover har forskning givet antydning til, at de også kan nedsætte T-cellefunktionen (9). Apoptose-medieret immunmodulering kan også have en vigtig effekt på helingsprocessen. Det er blevet demonstreret, at injiceret MSC’er undergår apoptose i tilstedeværelsen af cytotoksiske celler (NK-celler og T-celler). Kort fortalt er efterfølgende fagocystose af makrofager ultimo resultatet af den immunosuppressive aktivitet (10). Dette er bare etfåtal eksempler på stamcellers virkningsmekanismer. Flere studier demonstrerer andre komplekse immunmodulerende egenskaber, såsom MSC homing (11). Stamceller klassificeres efter deres oprindelse som *embryonale* (ESC), *adulte* (HSC og MSC) og inducerede *pluripotente* stamceller (IPSC) (12, 13). Ud fra et udviklings- og differentieringsfase niveau kan de klassificeres yderligere som totipotente, pluripotente eller multipotente
celler (14).
Totipotente stamceller er kun til stede i et meget tidligt embryo under morulastadiet, før gastrulationen begynder. Den første isolering og anvendelse af disse celler i mennesker var i 1998 (15). De er i stand til at udvikle sig til alle embryonale og ekstra-embryonale væv. De er i stand til at udvikle til enhver type celle fra hver af de tre germinale lag (endoderm, mesoderm, ectoderm), såvel som ekstraembryonale membraner (fx placenta og navlestreng). På trods af deres enorme potentiale i celleterapi følger der en række iboende ulemper med ved brugen af denne type stamcelle. Fremskaffelse af embryonale celler er en meget kompleks og dyrere procedure end ved tilvejebringelse af andre typer stamceller. Der er også en større risiko for tumorogenese og immunafstødning ved anvendelse af disse celler. Derudover er der er også de moralske, etiske og juridiske begrænsninger for dets brug (16, 17, 18). Subsekvent deling af disse celler under tidlig embryonal udvikling fører til fremkomsten af blastocysten, som har en pluripotente ESC til stede i den indre cellemasse. ESC’er kan give ophav til alle vævsceller i kroppen, med undtagelse af ekstra-embryonale væv og kønsceller (12, 19).
Som et alternativ til ESC’er udviklede Takahashi og Yamanaka i 2006 en metode til isolering af pluripotente stamceller. De omprogrammerede adulte muse fibroblaster til pluripotente stamceller ved en retroviral transduktion af fire specifikke gener. Disse celler blev betegnet IPSC og ligner ESC i deres morfologi, vækstegenskaber og i ekspressionen af ESC-markørgener. Selvom opdagelsen af IPSC var et bemærkelsesværdigt fremskridt inden for stamcelleterapi, er der mulighed for at retrovirale transduktioner skaber kromosomale ændringer, som øger risikoen for tumorogenese, hvilket rejser spørgsmål om sikkerheden ved brug af IPSC til regenerativ medicin (13).
Ved yderligere celleudvikling mister pluripotente ESC gradvist deres pluripotens og bliver multipotente. Det multipotente stadie er karakteriseret ved cellernes evne til at differentiere til begrænsede typer af specifikke celler, ofte afhængigt af deres kimlagsoprindelse (20). Denne celleudvikling foregår ved dyrets føtale eller adulte livsstadie, hvilket giver en mere håndgribelig etisk og moralsk løsning på fremskaffelsen af stamcellerne uden at omkostninger løber løbsk.
Blod fra knoglemarv og navlestreng indeholder hæmatopoietiske stamceller (HSC) og ikke-hæmatopoietiske eller mesenkymale/stromale stamceller (MSC), hvor sidstnævnte også findes i adskillige andre væv. Disse celler er multipotente, fordi de kan differentiere til specifikke kropscelletyper. Hæmatopoitiske stamceller kan differentiere til forskellige celler i immunsystemet, trombocytter og erytrocytter. Mesenkymale stamceller differentierer sig til for eksempel osteocytter (knogle), chondrocytter (brusk), fibroblaster (ledbånd, sener, bindevæv) adipocytter (fedt), keratinocytter (hud), tenocytter (sener), astrocytter (nerver) og myocytter (muskler). MSC’er aktiveres endogent, når det er nødvendigt at erstatte døde, skadede eller syge vævsceller (4). Tidlige undersøgelser fra de sene 1960’ere af disse multipotente celler viste, at de var i stand til at differentiere til osteoblaster, chondroblaster og adipocytter (21). Dette fører til troen på, at MSC’er viser deres terapeutiske potentiale gennem differentiering til specifikke vævsceller (22, 23). Dog har adskillige efterfølgende undersøgelser sat spørgsmålstegn ved dette, og i dag menes det, at den primære mekanisme for MSC’er regenerative evner stammer fra deres immunmodulerende- og vævsreparations-mekanismer. Det formodes, at perivaskulær lokalisering af MSC’er i adskellige væv spiller en væsentlig rolle, og sætter disse celler i stand til at detektere en lokal eller fjern vævsskade og reagere på dette ved en specifik orienteret migration til skadestedet og deltagelse i helingsprocessen (24). Denne formodning ledte til, at Caplan foreslog at ændre udtrykket ”mesenkymale stamceller” til ”medicinsk signalcelle” (MSC) (25).
Blandt forskellige stamcelletyper synes mesenkymale stamceller (MSC) i øjeblikket at være de mest velegnede til terapeutiske formål, baseret ud fra deres enkle isolerings- og dyrkningsteknikker, forholdsvist højt celleudbytte ved høstningsprocessen og mangel på etiske spørgsmål vedrørende deres anvendelse. På grund af deres bemærkelsesværdige immunmodulerende evner vinder MSC’er i stigende grad også anerkendelse inden for veterinærmedicinsk anvendelse. Udviklingen er primært drevet af de nuværende behandlingsmuligheders begrænsninger for forskellige medicinske problemer hos forskellige dyrearter. MSC’er repræsenterer en mulig terapeutisk mulighed for mange dyresygdomme, såsom ortopædiske, orale, dentale, fordøjelsessygdomme, lever-, nyre-, hjerte-, respiratoriske-, neuromuskulære-, dermale-, olfaktoriske-, okulære- og reproduktive systemiske sygdomme. Selvom vi gradvist har opnået en forståelse af MSC-adfærd og deres virkningsmekanismer, er nogle af de problemer, der gør at vi overvejer deres brug til terapi, endnu ikke løst.
Denne sandsynlige terapeutiske mulighed har skab fokus på mange immun-medierede sygdomme. Med den fortsat stigende diagnose-frekvens af immunmedierede sygdomme hos smådyr, såsom for eksempel kronisk gastoenteritis, atopisk dermatitis, felin kronisk gingivo-stomatitis og felin astma vil interessen for forskning i disse lidelser og deres medicinske behandling også fortsætte (26, 27). Samtidig har adulte stromale stamceller vist sig at være non-tumorogene og non-immunogene (28).
Konventionel immunmodulerende terapi såsom glukokortikoider eller andre nye terapier såsom cyclosporin eller monoklonale antistoffer er forbundet med adskillige bivirkninger, der begrænser dets langsigtede brug i behandling af disse refraktære sygdomsstilstande (29), hvilket fører til behovet for mere effektive – og udvikling af mere sikre terapeutiske –
strategier.
Eksempler på klinisk applikation af stamceller
Når MSC’erne er høstet, isoleret, selekteret og kørt igennem flere passager af ekspansion, bliver de selvfølgelig også testet for sygdomme, inden de endelige administreres til patienten. MSC kan administreres både systemisk og lokalt, det er ofte afhængigt af det ønskede resultat af behandlingen, og hvilken sygdom som behandles. For eksempel kan immunmodulerende virkninger opnås ved systemisk levering af nogle sygdomme, og transplantation af celler til et lokalt væv er muligvis ikke nødvendigt. Intravenøs levering er kendt for eventuelt at føre til pulmonal ophobning af cellerne, hvilket kan eller måske i sidste ende påvirker det terapeutiske resultat (30) Ved lokaliseret sygdom eller skade på et område, hvor der ønskes ny vækst af vævet, kan leveringen af stamceller til det specifikke område være mest ideel. Denne form for levering er for eksempel oftest anvendt ved muskuloskeletale lidelser.
Orale lidelser (felin kronisk gingivo-stomatitis)
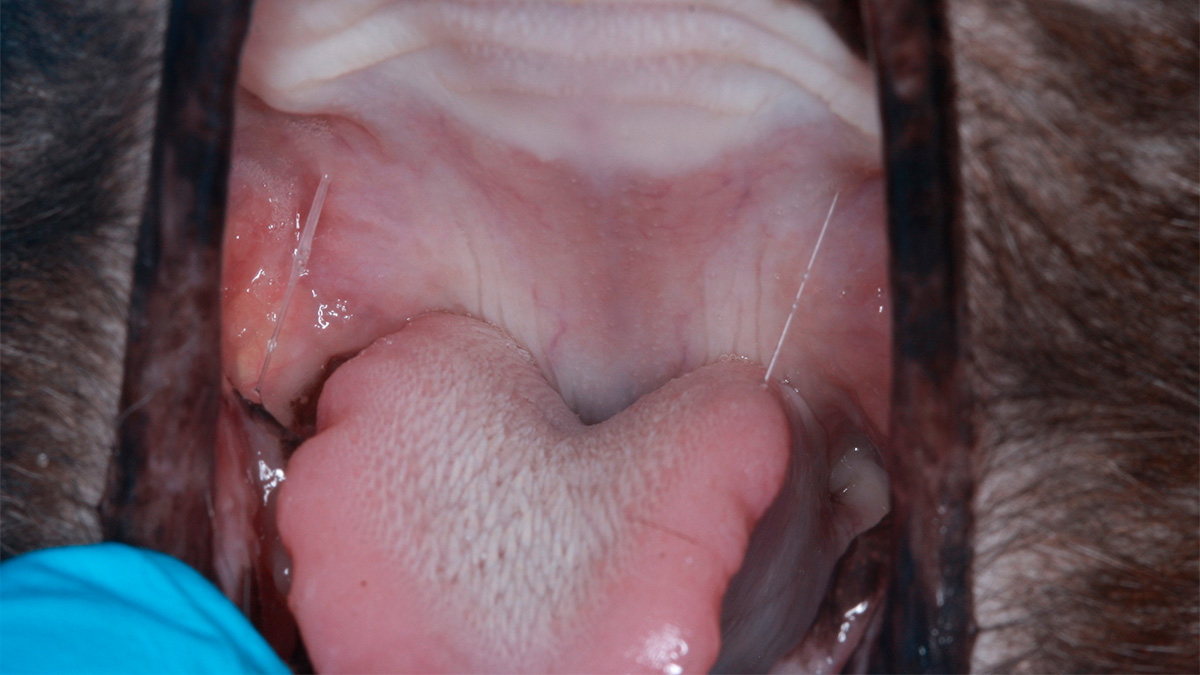
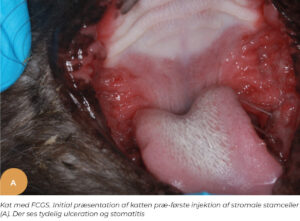
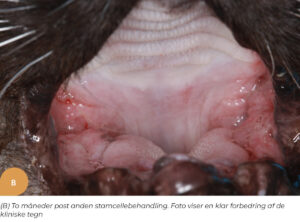
Oral smerte og mastikationsproblemer kan have stor indflydelse på kvaliteten af dyrets liv. Mange orale sygdomme kan også føre til systemiske problemer (26). Et område, som har skabt stor omtale, er behandlingen af felin kronisk gingivo-stomatitis (FCGS). Felin kronisk gingivostomatitis er en smertefuld og invaliderende oral sygdomstilstand hos katte, karakteriseret ved kronisk betændelse i tandkødet og den orale mukosa, der strækker sig fra den orofaryngeale slimhinde til den bukkale og kaudale mundslimhinde. Katte, der lider af FCGS, præsenteres oftest med anoreksi, orale smerter, vægttab, ptyalisme, og halitose (31). Nuværende behandlingsmodliteter omfatter medicinsk eller kirurgisk behandling. Medicinsk behandling såsom kortikosteroider (32), cyclosporin (33) og kirurgisk udtrækning af tænder (34) har variabel responsrate og flere mulige bivirkninger (35). Arzi et al. viste, at behandling med MSC resulterede i fuldstændig klinisk og histologisk opløsning eller reduktion i sværhedsgraden af den kliniske sygdom hos de fleste katte. Det kliniske, histologiske og systemiske respons blev påvist i 70 procent af kattene med FCGS behandlet med IV administration af MSC (26).
Forfatteren til nærværende artikel har selv været involveret i disse forsøg og ved selvsyn set den immunmodulerende effekt af denne behandlingsform.
Okulære lidelser
Stamcelleterapi er også udbredt indenfor oftalmologi. Visse øjensygdomme, for eksempel kornea ulcus, der er svære at behandle og til tider uhelbredelige med tidligere tilgængelige metoder, kan måske med tiden behandles med stamcelle terapi. For eksempel blev heste med kronisk korneal ulcus, der var non-responsivt til traditionelle behandlingsformer i et studie behandlet med hæmopoitiske stamceller, og denne behandling viste signifikant forbedring og opheling af kornea (36). Hos katte med felin eosinofil keratitis har subkonjuntival implanteret stamceller vist sig at kunne reducere de kliniske symptomer (37). Implantation af adipøse stamceller lokalt omkring tårekirtlen gav en signifikant reduktion af kliniske tegn hos hunde med keratoconjunctivitis sicca (KCS eller ”dry eye”), dog er længerevarende opfølgning manglende (38). Tilsvarende har undersøgelsen af Sgrignoli et al. vist, at ekspressionen af KCS-markørerne CD4, IL-6, IL-1 og TNF-a hos hunde var reduceret signifikant seks måneder efter gentagen topikal administration af stromale stamceller (39).
Muskuloskeletale lidelser
Traumatiske skader og belastningsskader af sener og ledbånd heler naturligt med dannelsen af arvæv, som er funktionelt mangelfuldt i forhold til rask væv (40). Dette resulterer i kompromitteret bevægelsesfunktion, der giver tilbøjelighed til, at skaden kan bryde op igen (41). Den optimale behandling bør derfor sigte mod at genoprette normal struktur og funktion af vævet. Traditionelle terapier for disse former for skade er oftest baseret på ”RICE-princippet” ro, afkøling, bandagering og løftet over hjerteniveau hvis muligt, samt en langsom og kontrolleret genoptræningsperiode (42). Den farmakologiske komponent af behandlingen omfatter oftest brugen af systemiske og lokale kortikosteroider eller andre antiinflammatoriske lægemidler, som stadigvæk er en meget praktiseret behandlingsform for mange dyrlæger, men kirurgisk behandling er også udført (43). Stamcelleterapi er blevet introduceret som en alternativ form for behandling af disse skader, da den har et potentiale for regeneration af vævet. Det er forfatterens opfattelse af flere danske dyrlæger har praktiseret denne alternative behandling af heste i flere år. Det har vist at give en klinisk signifikant kortere helingstid (44) og reduceret genbeskadigelse (45). Studier på hunde med partial eller fuld cranial cruciate ligament ruptur har ligeledes vis lovende resultater. Ved komplet ruptur af ligamentet har stamceller vist sig at have en lokal antiinflammatorisk effekt ved intraarticular injektion (46). I et studie af hunde med partial ruptur anvendte man autolog benmarvs-MSC’er i kombination med Platelet-Rich Plasma (PRP), som forhindrede progression af yderligere degenerative ændringer i leddet og kontralateral ligamentruptur (47).
Inflammatorisk tarmsygdom (IBD)
Inflammatorisk tarmsygdom (IBD) er en autoimmun tilstand af ukendt ætiologi, som forårsager en kronisk hypersensitiv reaktion i tarmslimhinden. Nogle hunde er modstandsdygtige over for de traditionelle livslange behandlinger med cyclosporin eller steroider. Behandling med MSC’er har resulteret i klinisk remission af et overvældende antal af hunde med svær IBD, blot seks uger efter endt behandling (48). IBD er også relativt almindelig hos katte. I et placebokontrolleret blindt studie blev katte med IBD behandlet med mesenkymale stamceller. Artiklen rapporterede betydelig forbedring eller fuldstændig symptomfri for kliniske tegn hos 70 procent af kattene, som fik stamcellebehandling (49).
Respiratoriske lidelser (felin astma)
Luftvejssygdomme som for eksempel felin astma er også et relativt almindeligt problem inden for det veterinærmedicinske fag. Et pilotstudie fandt, at MSC’er kan have en forsinket effekt med hensyn til at reducere luftvejsbetændelse, luftvejs-hyperrespons og remodulering hos eksperimentelt inducerede astmatiske katte. Resultaterne var dog ikke konklusive, og yderligere undersøgelse af stromal stamcelle-terapi af astma katte er nødvendigt (50).
Reproduktionslidelser
Flere undersøgelser har haft fokus på at finde nye terapier til at forbedre fertiliteten. Dette kan have både kommercielle formål hos husdyr og kan eventuelt formå at opnå en translation til human medicin. Forskere har forsøgt at genoprette fertiliteten af ovarier hos hopper ved at injicere stamceller i ovariet uden held. Ligeledes kunne ovariefunktionen ikke
forbedres eller genoprettes (51).
Interessant nok ser hundesæd ud til at være modtagelig for behandling med ECV fra adipøse mesenkymale stamceller under kryokonservering. Tilføjelsen af ECV’er har vist at reducere antallet af beskadigede sædcellers fald af reaktive iltforbindelser (ROS) i optøet sæd (52). Baseret på resultaterne fra behandlingen af andre betændelsestilstande er der håb om, at patologier i reproduktive organer også vil være modtagelige for MSC-behandlingen.
Nye stamcellebehandlinger i Danmark
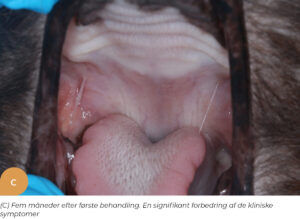
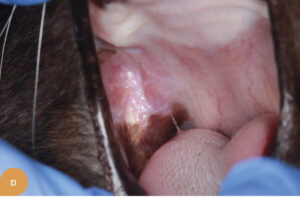
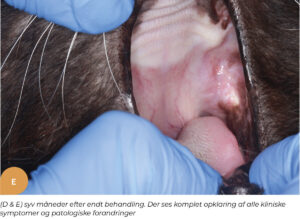
På Specialistdyrehospitalet i Holte tilbydes fra sommeren 2022 mesenkymal stamcelleterapi af orale lidelser, såsom felin kronisk gingivostomatitis, som et led i den terapeutisk behandling af denne invaliderende refraktære sygdom hos katte. Peter Strøm, dyrlæge og internationale specialist i odontologi og oromaxillofacial kirurgi, har detaljeret indblik og erfaring med denne type behandling fra sit uddannelsesophold i USA. Dette har ledt til introduktion af denne behandlingsmodalitet på hospitalet som det første og indtil videre eneste sted i Danmark. De initielle resultater af behandlingsformen for denne sygdom har vist sig særdeles lovende (Figur 1.). Stamcelleterapi vil også kunne tilbydes i den nære fremtid til behandling af visse okulære sygdomme på Specialistdyrehospitalets øjenafdeling under ledelse af internationale øjenspecialist, Ann Strøm.
Mulig eksperimentel regenerativ behandling (videnskabelige studier) af andre lidelser og sygdomme vil ligeledes blive aktuelt i den kommende tid.
Begrænsninger og perspektiver for fremtidig brug af stamcelleterapi
Stamcellerne anses på grund af deres særlige egenskaber som selvfornyelse, multiplikation, homing, immunmodulering, anti-inflammatorisk og differentiering at bære en ”alt-i-én-løsning” til forskellige kliniske problemer. Midlertidige begrænsninger og manglende forståelse af den cellulære fysiologi i øjeblikket, begrænser den nutidige anvendelse til specifikke lidelser.
Selvom regenerativ medicin er et spændende område med stor interesse for det potentiale, det rummer, er det også meget komplekst og uden for et standardpensum for de fleste nuværende veterinæruddannelser. Manglende viden om den komplekse tilvejebringelse af stamceller og reglementer, kombineret med et stærkt ønske om at hjælpe patienter, kan føre til misforståelser blandt ejere og klinikere. American Veterinary Medical Association’s (AVMA) politik om terapeutisk brug af stamceller og regenerativ medicin beretter, at ”dyrlæger har for få retningslinjer og begrænsede ressourcer til at differentiere gyldige og effektive behandlinger fra dem, der har utilstrækkelig dataunderstøttelse. Derfor påhviler det dyrlæger, der beskæftiger sig med regenerative behandlingsterapier, at være velbevandret i den nyeste videnskab inden for området, for med succes at kunne udvælge de specifikke terapeutiske protokoller, processer, udstyr og leverandører, der mest sandsynligt vil resultere i klinisk fordel for deres patienter.” (53).
Dog er der endnu ingen standardregulativer for deres anvendelse, hverken fra Food and Drug Administration (FDA) eller Det Europæiske Lægemiddelagentur (EMA). Dette skyldes højst sandsynligt, at flere data og definitioner af standardiserede protokoller er nødvendige, før sådanne kan indføres.
Denne mangel har desværre blandt andet i USA, såvel som Europa, ført til mange ubeviste og usikre praksisser ved brug af regenerative terapier. Det har faktisk resulteret i at Google indførte et reklameforbud for ubeviste og ikke-godkendte stamcelleterapier i 2019. Efter forfatterens bedste overbevisning er der i øjeblikket ingen veterinær (FDA og EMA) – godkendte regenerative terapier. FDA’s Center for Veterinærmedicin har dog udgivet en vejledning i 2015 om, at cellebaserede terapeutiske behandlinger anses som nye lægemidler (54). I 2017 udgav AVMA et dokument med titlen ”Terapeutisk brug af stamceller og regenerativ medicin”, der inkluderer specifikke retningslinjer for brugen af stamceller og andre regenerative terapier (53). Ligeledes har EMA frigivet et reflektionsdokument (retningslinjer) i 2011 om samme emne, bare for humanmedicin og ingen for veterinær brug (55). Ønsket med dokumenterne var at få medicinske fagfolk til at følge godkendte retningslinjer. Det er dog forfatterens opfattelse af disse retningslinjer er meget løst sammensat, og produktionen af stamceller til veterinær brug ikke er så kontrolleret, som det burde være.
Formålet med denne artikel er at give klinikere en grundlæggende gennemgang af stamceller og et begrænset resumé af enkelte aktuelle tilgængelige data og deres kliniske anvendelse til vores kæledyr. På nuværende tidspunkt viser adskillige *in vitro* og *in vivo* studier af specifikke stamcelletyper og terapier potentiale til behandling af specifikke sygdomme. Yderligere undersøgelser er dog nødvendige for at legitimere en mere bred anvendelse af disse celler på terapeutisk plan.
Referenceliste
- Fortier LA, Travis AJ. Stem cells in veterinary medicine. Stem Cell Res Ther. 2011 Feb 23;2(1):9.
- Morrison SJ, Wandycz AM, Hemmati HD, Wright DE, Weissman IL. Identification of a lineage of multipotent hematopoietic progenitors. Development. (1997)
- Pérez-Merino EM, Usón-Casaús JM, Zaragoza-Bayle C, Duque-Carrasco J, Mariñas-Pardo L, Hermida-Prieto M, et al. Safety and efficacy of allogeneic adipose tissue-derived mesenchymal stem cells for treatment of dogs with inflammatory bowel disease: clinical and laboratory outcomes. Vet J. 2015.
- Caplan AI. Mesenchymal stem cells: time to change the name! stem cells. Transl Med. (2017). 6:1445–51.
- Souza-Moreira L, Soares VC, Dias S, Bozza PT. Adipose-derived mesenchymal stromal cells modulate lipid metabolism and lipid droplet biogenesis via AKT/mTOR -PPAR signalling in macrophages. Sci Rep. (2019).
- Gao WX, Sun YQ, Shi J, Li CL, Fang SB, Wang D, et al. Effects of mesenchymal stem cells from human induced pluripotent stem cells on differentiation, maturation, and function of dendritic cells.
Stem Cell Res Ther. (2017). - Laing AG, Fanelli G, Ramirez-Valdez A, Lechler RI, Lombardi G, Sharpe PT. Mesenchymal stem cells inhibit T-cell function through conserved induction of cellular stress. PLoS ONE. (2019).
- Abels ER, Breakefield XO. Introduction to extracellular vesicles: biogenesis, RNA cargo selection, content, release, and uptake. CellMol Neurobiol. (2016).
- Crain SK, Robinson SR, Thane KE, Davis AM, Meola DM, Barton BA, et al. Extracellular vesicles from Wharton’s Jelly mesenchymal stem cells suppress CD4 expressing T cells through transforming growth factor beta and adenosine signaling in a canine model. Stem Cells Dev. (2019).
- Galleu A, Riffo-Vasquez Y, Trento C, Lomas C, Dolcetti L, Cheung TS, et al. Apoptosis in mesenchymal stromal cells induces in vivo recipient-mediated immunomodulation. Sci Transl Med. (2017).
- Penn MS. SDF-1:CXCR4 axis is fundamental for tissue preservation and repair. Am J Pathol. (2010).
- Evans MJ, Kaufman MH. Establishment in culture of pluripotential cells from mouse embryos. Nature. (1981).
- Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. (2006).
- Wagers AJ,Weissman IL. Plasticity of adult stem cells. Cell. (2004).
- Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, et al. Embryonic stemcell lines derived fromhuman blastocysts. Science. (1998).
- Jiménez A, Guerrero F. Células madre mesenquimales como nueva terapia en dermatología: conceptos básicos. Rev clínica dermatología Vet. 2017.
- Harman RJ. Stem cell therapy in veterinary dermatology. Vet Dermatol. 2013.
- Ayala-cuellar AP, Kang J, Jeung E, Choi K. Roles of mesenchymal stem cells in tissue regeneration and immunomodulation. Biomol Ther. 2019.
- Martin GR. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells.
Proc Natl Acad Sci USA. (1981). - Thomson JA,Marshall VS. Primate embryonic stem cells. Curr Top Dev Biol. (1998).
- Dennis JE, Merriam A, Awadallah A, Yoo JU, Johnstone B, Caplan AI. A quadripotential mesenchymal progenitor cell isolated from the marrow of an adult mouse. J Bone Miner Res. (1999).
- Miyahara Y, Nagaya N, Kataoka M, Yanagawa B, Tanaka K, Hao H, et al.
Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction. Nat Med. (2006). - Quinn C, Flake AW. In vivo differentiation potential of mesenchymal stem cells:
prenatal and postnatal model systems.
Transfus Med Hemother. (2008). - Niess H, Thomas MN, Schiergens TS, Kleespies A, Jauch KW, Bruns C, et al. Genetic engineering of mesenchymal stromal cells for cancer therapy: turning partners in crime into Trojan horses.
Innov Surg Sci. (2016). - Caplan AI. Mesenchymal stem cells: time to change the name! stem cells. Transl Med. (2017).
- Arzi B, Clark K, Sundaram A. Therapeutic efficacy of fresh, allogeneic mesenchymal stem cells for severe refractory Gingivostomatitis in Cats.
Stem Cells Transl Med. 2017. - Quimby JM, Borjesson DL. Mesenchymal stem cell therapy in cats: current knowledge and future potential. J Feline Med Surg. 2018.
- Zheng S, Gao Y, Chen K, Liu Y, Xia N, Fang F.
A Robust and Highly Efficient Approach for Isolation of Mesenchymal Stem Cells From Wharton’s Jelly for Tissue Repair.
Cell Transplantation. January 2022 - Carrade DD, Borjesson DL. Immunomodulation by mesenchymal stem cells in veterinary species. Comp Med. 2013.
- Eggenhofer E, Benseler V, Kroemer A, et al. Mesenchymal stem cells are shortlived and do not migrate beyond the lungs after intravenous infusion. Front Immunol 2002.
- Bellei E, Dalla F, Masetti L, Pisoni L, Joechler M.
Surgical therapy in chronic feline gingivostomatitis (FCGS).
Vet Res Commun. (2008) 32(Suppl. 1) - Hennet PR, Camy GA, McGahie DM, Albouy MV. Comparative efficacy of a recombinant feline interferon omega in refractory cases of caliciviruspositive cats with caudal stomatitis: a randomised, multi-centre, controlled, double-blind study in 39 cats. J Feline Med Surg. (2011).
- Lommer MJ. Efficacy of cyclosporine for chronic, refractory stomatitis in cats: a randomized, placebo-controlled, double-blinded clinical study.
J Vet Dent. (2013). - Druet I, Hennet P. Relationship between feline calicivirus load, oral lesions, and outcome in feline chronic gingivostomatitis (caudal stomatitis):
retrospective study in 104 cats. Front Vet Sci. (2017). - Winer JN, Arzi B, Verstraete FJ. Therapeutic management of feline chronic gingivostomatitis: a systematic review of the literature.
Front Vet Sci. (2016). - Marfe G, Massaro-Giordano M, Ranalli M, Cozzoli E, Di Stefano C, Malafoglia V, et al. Blood derived stem cells: an ameliorative therapy in veterinary ophthalmology. J Cell Physiol. (2012).
- Villatoro AJ, Claros S, Fernandez V, Alcoholado C, Farinas F, Moreno A, et al. Safety and efficacy of the mesenchymal stem cell in feline eosinophilic
keratitis treatment. BMC Vet Res. (2018). - Villatoro AJ, Fernandez V, Claros S, Rico-Llanos GA, Becerra J, Andrades JA. Use of adipose-derived mesenchymal stem cells in keratoconjunctivitis sicca in a canine model. Biomed Res Int. (2015).
- Sgrignoli MR, Silva DA, Nascimento FF, Sgrignoli DAM, Nai GA, da Silva MG, et al. Reduction in the inflammatory markers CD4, IL-1, IL-6 and TNF in dogs with keratoconjunctivitis sicca treated
topically with mesenchymal stem cells.
Stem Cell Res. (2019). - Dakin SG, Jespers K, Warner S, O’Hara LK, Dudhia J, Goodship AE, et al. The relationship between in vivo limb and in vitro tendon mechanics after injury: a potential novel clinical tool for
monitoring tendon repair. Equine Vet J. 2010. - Dyson SJ. Medical management of superficial digital flexor tendonitis: a comparative study in 219 horses (1992-2000). Equine Vet J. (2004).
- Petrov R, MacDonald MH, Tesch AM, Van Hoogmoed LM. Influence of topically applied cold treatment on core temperature and cell viability in equine superficial digital flexor
tendons. Am J Vet Res. (2003) - Chan KM, Fu SC. Anti-inflammatory management for tendon injuries – friends or foes? Sports Med Arthrosc Rehabil Ther Technol. (2009)
- Pacini S, Spinabella S, Trombi L, Fazzi R, Galimberti S, Dini F, et al. Suspension of bone marrow-derived undifferentiated mesenchymal stromal cells for repair of superficial digital flexor tendon in race horses. Tissue Eng. (2007).
- Godwin EE, Young NJ, Dudhia J, Beamish IC, Smith RK. Implantation of bone marrow-derived mesenchymal stem cells demonstrates improved outcome in horses with overstrain injury of the superficial digital flexor tendon. Equine Vet J. (2012).
- Linon E, Spreng D, Rytz U, Forterre S. Engraftment of autologous bone marrow cells into the injured cranial cruciate ligament in dogs. Vet J. (2014).
- Canapp SO Jr., Leasure CS, Cox C, Ibrahim V, Carr BJ. Partial cranial cruciate ligament tears treated with stem cell and platelet-rich plasma combination therapy in 36 dogs: a retrospective study. Front Vet Sci. (2016).
- Perez-Merino EM, Uson-Casaus JM, Duque-Carrasco J, Zaragoza-Bayle C, Marinas-Pardo L, Hermida-Prieto M, et al. Safety and efficacy of allogeneic adipose tissue-derived mesenchymal stem cells for treatment of dogs with inflammatory bowel disease: Endoscopic and histological outcomes. Vet J. (2015)
- Webb TL, Webb CB. Stem cell therapy in cats with chronic enteropathy: a proof-of-concept study.
J Feline Med Surg. (2015). - Trzil JE, Masseau I, Webb TL, Chang CH, Dodam JR, Liu H, et al. Intravenous adipose-derived mesenchymal stem cell therapy for the treatment of feline asthma: a pilot study.
J Feline Med Surg. (2016). - Grady ST, Watts AE, Thompson JA, Penedo MCT, Konganti K, Hinrichs K. Effect of intra-ovarian injection of mesenchymal stem cells in aged
mares. J Assist Reprod Genet. (2019). - Qamar AY, Fang X, Kim MJ, Cho J. Improved post-thaw quality of canine semen after treatment with exosomes from conditioned medium of adipose-derived mesenchymal stem cells.
Animals. (2019). - American Veterinary Medical Association policy on therapeutic use of stem cells and regenerative medicine. 2017.
Available at: https://www.avma.org/KB/ Policies/Pages/Therapeutic-Use-of-Stem-Cells-and-Regenerative-Medicine.aspx. Accessed August 6, 2022 - U.S. Department of Health and Human Services Food and Drug Administration Center for
Veterinary medicine guidance for industry #218: cell-based products for animal use. 2015. Available at https://www.fda.gov/media/88925/download. Accessed August 6, 2022 - European Medicine Agency/Committee for Medicinal Products for Veterinary Use (CVMP). Questions and Answers on allogenic stem cell-based products for veterinary use: specific questions on sterility. 2015. Available at: https://www.ema.europa.eu/en/documents/scientific-guideline/questions-answers-allogenic-stem-cell-based-products-veterinary-use-specific-questions-sterility_en.pdf. Accessed August 6, 2022.